转自:国家食品药品监督管理总局食品药品审核查验中心
发布时间:2018-07-24 原文链接:https://www.cfdi.org.cn/resource/news/10594.html
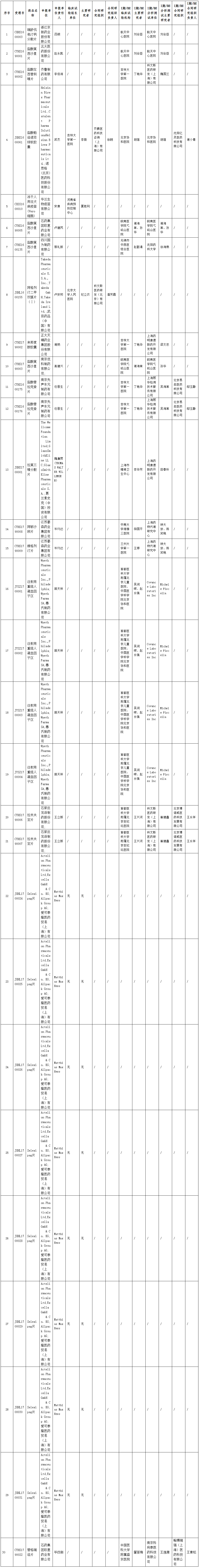
根据《国家食品药品监督管理总局药物临床试验数据核查工作程序(暂行)》(食药监药化管〔2016〕34号)要求,计划对瑞舒伐他汀钙分散片(受理号:CXHS1600003)等30个药物临床试验数据自查核查品种(详见附件)开展现场核查,现予公示。公示期为10个工作日,即2018年7月24日至2018年8月6日。
公示期结束后,即开展现场核查。
联系电话:010-68441500;联系人:宁靖、李秀丽
联系传真:010-68441300
联系地址:北京市西城区文兴街1号院3号楼北矿金融大厦6层; 邮编:100044
特此公告。
附:药物临床试验数据现场核查品种目录
联系传真:010-68441300
联系地址:北京市西城区文兴街1号院3号楼北矿金融大厦6层; 邮编:100044
特此公告。
附:药物临床试验数据现场核查品种目录
原国家食品药品监督管理总局食品药品审核查验中心(暂)
2018年7月24日
药物临床试验数据现场核查品种目录