医疗器械事业部介绍
博诺威顺应市场规律,在国内CRO中率先成立专门的医疗器械事业部,为客户提供专业的医疗器械、诊断试剂临床试验及注册服务。博诺威医药科技发展有限公司医疗器械事业部下设专业的学术团队、注册团队和临床试验操作团队,并聘请多位业内专家为技术顾问,提供长期技术支持及指导。博诺威目前已经完成心脏支架、外周球囊、骨科器械、眼科器械、防粘连及修复材料、诊断试剂等90多项产品注册、动物试验、临床研究工作,其中包括三项创新医疗器械。
博诺威医疗器械事业部的核心成员从事医疗器械注册及临床研究工作已达12年之久,可以独立为您的产品准备申报资料、形式检验、临床研究方案设计、方案实施以及后续注册工作。事业部的学术团队熟知医疗器械的政策法规及相关指导原则,临床操作团队与国内专业临床试验机构一直保持良好的合作关系;注册团队与NMPA和各区域省级检测机构保持良好的沟通。
我们一直坚持用专业的知识和优质高效的服务为客户创造最大价值,推动医疗器械行业健康发展!
博诺威医疗器械事业部业务范围
医疗器械临床试验过程包括方案设计、实施、监查、核查、数据管理、统计分析、撰写总结报告等。医疗器械临床试验应当遵循伦理原则、科学原则,并遵守《医疗器械临床试验规定》及其他相关法律法规。
一、境内医疗器械注册
1、承接注册检验
2、撰写注册文件
3、材料的整理及递交
二、动物实验
1、动物实验设计
2、动物实验实施
3、动物实验数据分析
4、动物实验报告撰写
三、医疗器械临床试验
1、临床试验设计
2、临床试验监查
3、数据管理及统计分析
4、总结报告撰写
涵盖领域
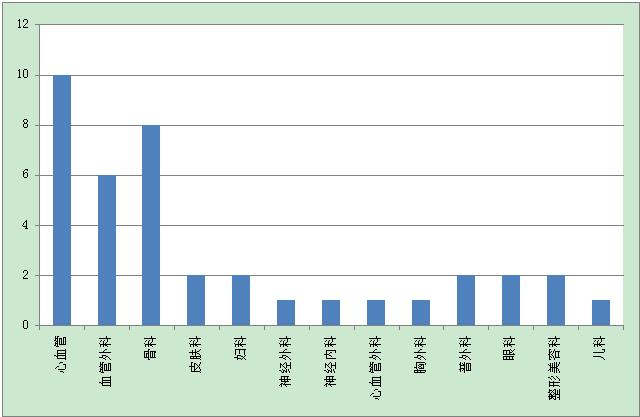
器械类别
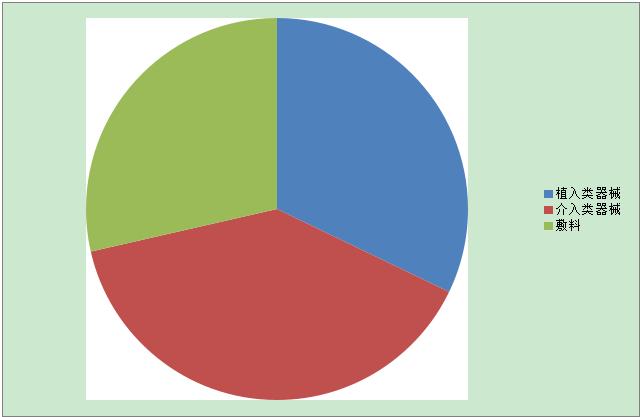
覆盖区域
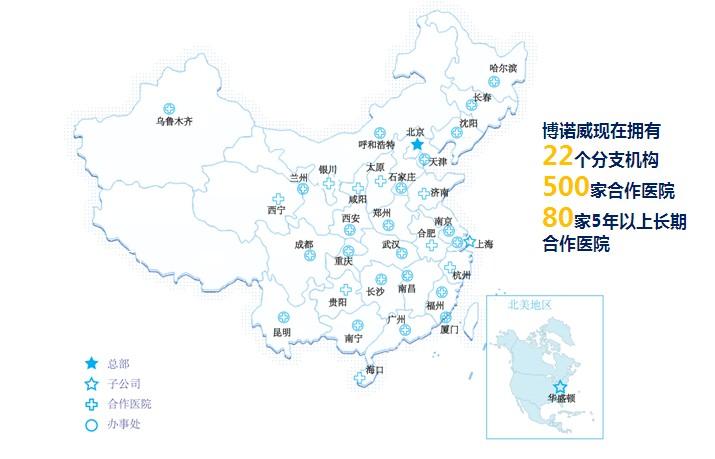
博诺威成绩
一、中国早期开始创新医疗器械临床试验的CRO;
二、中国开展创新医疗器械临床试验较多的CRO;
三、中国优先进入金属全降解医疗器械临床试验领域的CRO;
四、中国开展可降解医疗器械临床试验较多的CRO.
医疗器械临床试验为医疗器械在临床应用上的有效性和安全性提供科学的数据支持,也为产品注册提供依据。在获得注册上市后,前期的临床研究数据还可作为重要的原始资料用于市场推广目的。
项目经验
可吸收骨填充材料
|
No |
部分心血管类项目经验 |
|
1 |
心内介入鞘管 |
|
2 |
肾动脉消融治疗顽固性高血压 |
|
3 |
冠脉洗脱支架临床研究 |
|
4 |
心脏稳定器 |
|
5 |
心内标测电极导管 |
|
6 |
心内射频消融导管 |
|
7 |
全降解冠脉支架 |
|
8 |
室间隔封堵器 |
|
9 |
房间隔封堵器 |
|
10 |
房间隔穿刺针 |
|
11 |
血管鞘 |
|
|
部分血管外科项目经验 |
|
1 |
外周普通球囊 |
|
2 |
药物洗脱外周球囊 |
|
|
部分骨科项目经验 |
|
1 |
全降解骨钉 |
|
2 |
人工关节 |
|
3 |
颈椎后路内固定 |
|
|
部分敷料项目经验 |
|
1 |
腹部防粘连 |
|
2 |
宫内防粘连 |
|
3 |
创面敷料 |
|
4 |
注射用透明质酸钠凝胶 |
|
5 |
肌腱防粘连 |
|
6 |
止血敷料 |
|
7 |
脊柱防粘连 |
|
8 |
新生疤痕敷料 |
|
9 |
胶原蛋白修复贴 |
|
10 |
神经外科敷料 |
|
|
部分其他项目经验 |
|
1 |
射频热能皮肤治疗仪 |
|
2 |
疝气补片 |
|
3 |
人工晶体 |
|
4 |
可吸收缝合线 |
|
5 |
尿液分析仪+试纸 |
|
6 |
早期乳腺病变检测仪 |
|
7 |
激光治疗仪 |
|
8 |
X射线诊断机 |
|
9 |
高压注射器 |
|
10 |
肾透析液 |

